A epigenética é o estudo das alterações hereditárias na função dos genes que não estão associadas a nenhuma alteração na sequência do genoma. Enquanto a genética, como área de estudo, se concentra nos genes e em como as alterações na sequência do genoma podem levar a fenótipos hereditários e irreversíveis, a epigenética aborda como as alterações fenotípicas são provocadas pela ativação ou desativação controlada de genes sem qualquer alteração no código subjacente.
Um exemplo fantástico da epigenética em ação é a metamorfose de uma lagarta em borboleta. Uma borboleta possui o mesmo genoma da lagarta da qual se desenvolve. A epigenética garante a expressão dos genes certos no momento certo durante a metamorfose, ativando alguns genes e silenciando outros de forma controlada.
Regulação da expressão dos genes
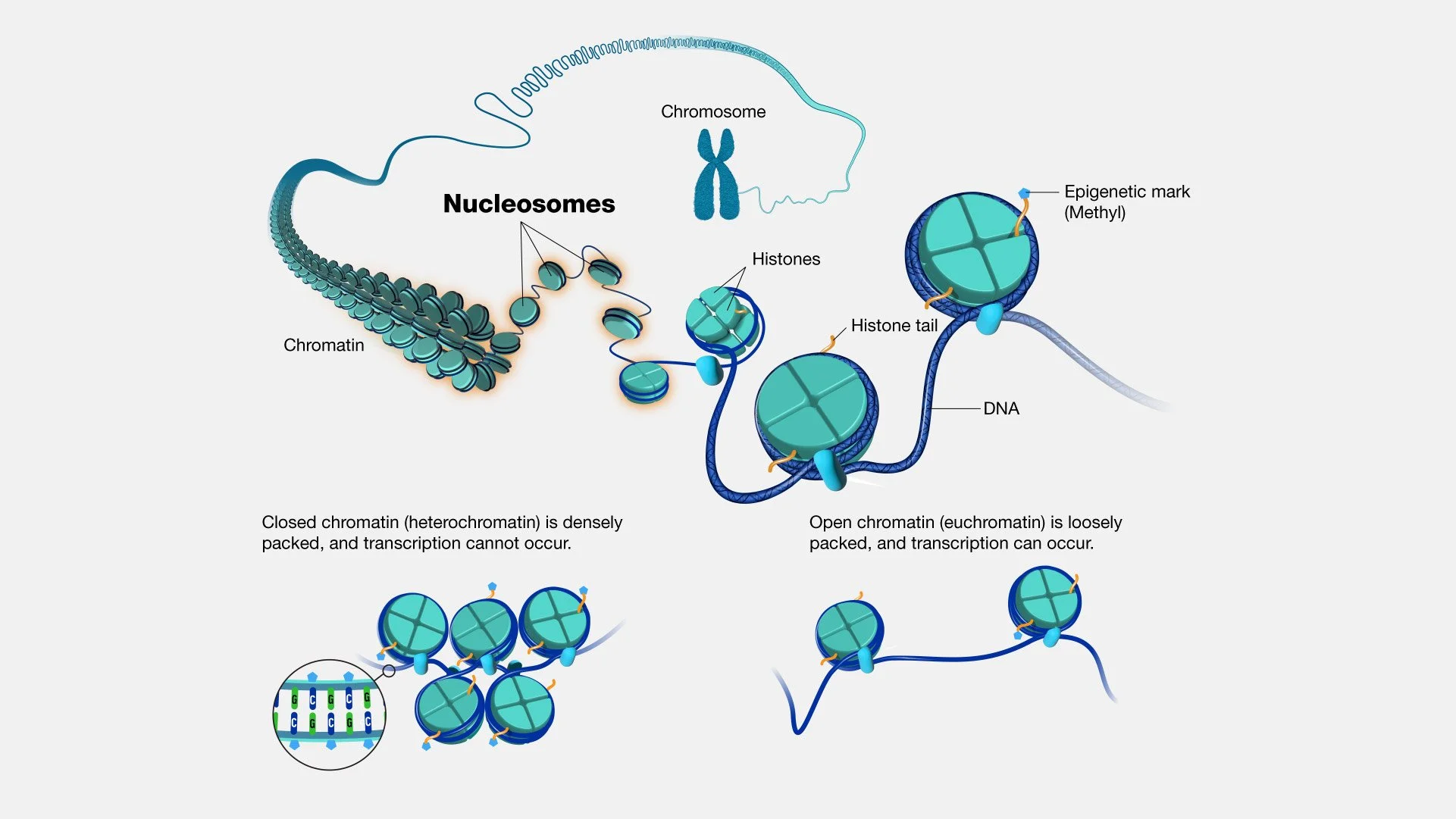
O DNA está dentro de cromossomos, compactados dentro do núcleo com o auxílio das histonas. As histonas são proteínas com carga positiva que se ligam fortemente às moléculas de DNA com carga negativa, formando complexos chamados nucleossomos.
Cada nucleossomo é composto por um trecho de DNA que se enrola exatamente 1,65 vezes em torno de oito proteínas histonas. Os nucleossomos se dobram em fibras de cromatina de uma maneira que lembra contas em um colar, e estas são ainda mais comprimidas e dobradas para produzir uma fibra de 250 nm de largura, que é firmemente enrolada na cromátide de um cromossomo.
Mas como tudo isso se relaciona com a epigenética? Em termos simples, o DNA que está firmemente enrolado em torno de histonas não pode ser transcrito porque não pode ser acessado pela maquinaria de transcrição, e tais sequências/genes, portanto, aparecerão silenciados.
Empacotamento e Desempacotamento Repetidos do DNA
Ao longo da embriogênese e da vida de qualquer organismo, a ativação e desativação repetidas de genes – por meio do desempacotamento e reempacotamento do DNA genômico – de maneira coordenada e regulada facilita a expressão gênica diferencial que permite a diferenciação de tipos celulares, órgãos e sistemas corporais com o mesmo código genético, mas com funções distintas, tudo a partir de uma única célula – um óvulo fertilizado.
Como ocorrem as mudanças epigenéticas?
A palavra epigenética deriva do grego ἐπι (Epi), que significa “sobre, fora de, ao redor”, e isso é bastante apropriado, visto que a epigenética ocorre por meio de características que se manifestam “acima” ou “em adição” à base genética tradicional da hereditariedade.
As alterações epigenéticas são desencadeadas por uma ampla gama de fatores, incluindo idade, fatores ambientais (como o uso de drogas, dieta, exercícios e exposição a substâncias químicas), doenças, bem como fatores comportamentais e psicológicos, como humor, estresse, depressão, ansiedade e outros.
As alterações epigenéticas também estão implicadas em doenças, e pesquisas recentes têm destacado a importância da epigenética em muitos tipos de câncer em humanos. Os fatores que influenciam a epigenética constituem um vasto campo de pesquisa que não será abordado em detalhes nesta série, mas você encontrará literatura interessante nesta coleção de revisões importantes sobre epigenética e transcrição.
Tipos de Alterações Epigenéticas
Vimos no vídeo acima que as alterações epigenéticas ocorrem de várias maneiras, incluindo metilação do DNA e do RNA, modificações de histonas e expressão de microRNA. Todas essas modificações influenciam a acessibilidade da cromatina à maquinaria de transcrição, incluindo fatores de transcrição, polimerases e outras proteínas necessárias para a transcrição gênica.
Metilação do DNA
Envolve a adição de um grupo metil a uma base, geralmente o 5º carbono de uma citosina. A metilação do DNA é a modificação epigenética mais intensa. A metilação no carbono 5 da citosina é denominada 5-metilcitosina (5-mC).
A 5-mC tem um efeito silenciador na região metilada e, em geral, quanto maior o nível de metilação em uma determinada sequência gênica, menor o nível de expressão desse gene. Uma modificação relacionada é a 5-hidroximetilcitosina (5-hmC). Ela parece funcionar como uma marca intermediária que, juntamente com outros processos, leva à desmetilação ativa da citosina, reativando assim uma região previamente metilada.
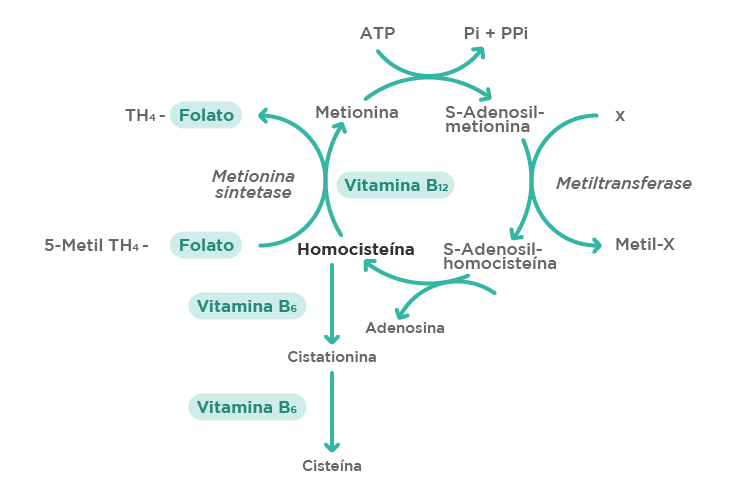
A adição de um grupo metil à citosina é catalisada por DNA metiltransferases (DNMTs) usando S-adenosilmetionina (SAM) como substrato. A SAM é o principal agente metilante presente em mamíferos e é derivada do ciclo da metionina.
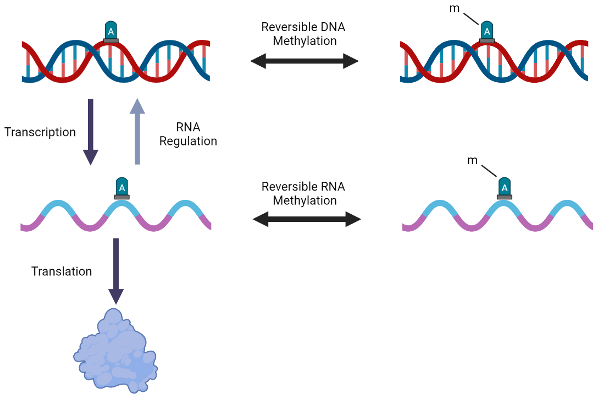
Metilação do RNA
A metilação do RNA é uma modificação pós-translacional reversível que ocorre em muitas espécies diferentes de RNA, incluindo mRNA, tRNA, rRNA, tmRNA, snRNA, snoRNA, miRNA e RNA viral.
A metilação do RNA é catalisada por RNA metiltransferases, sendo a N6-metiladenosina (m6A) e a 5-metilcitosina (5-mC) as marcas mais abundantes e comumente estudadas. A m6A sozinha representa 80% de toda a metilação do RNA em eucariotos e às vezes é chamada de "quinta base do RNA", com amplas funções na regulação do desenvolvimento embrionário e dos destinos celulares.
Pesquisas indicam que a metilação do RNA influencia a regulação de inúmeros processos biológicos, como a estabilidade do RNA e a tradução do mRNA, e a metilação anormal do RNA está implicada em muitas doenças humanas, incluindo o câncer.
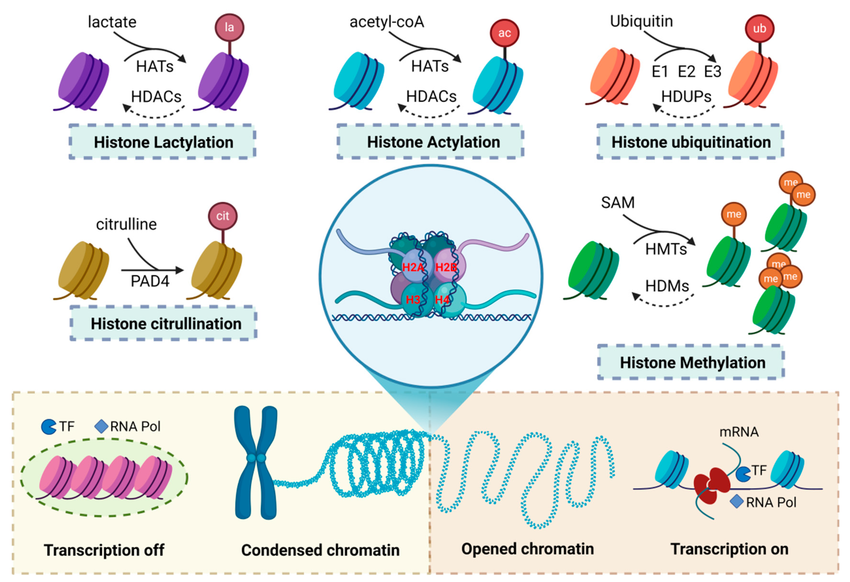
Modificações de Histonas
Existem cinco tipos principais de histonas (H) que, juntas, compreendem 9 histonas distintas: H1-H5, H2A, H2B, H3 e H4. As principais modificações epigenéticas ocorrem em H3 e H4. Essas modificações incluem a adição de grupos metil, acetil, fosfato ou ubiquitina a resíduos de aminoácidos fixos presentes nas caudas das sequências de proteínas histonas.
Embora o estudo da metilação de ácidos nucleicos possa nos dizer muito sobre como genes e transcritos individuais são ativados e desativados, o estudo de histonas e cromatina pode fornecer uma visão mais abrangente sobre:
• Como o DNA interage com as proteínas estruturais e enzimas envolvidas na epigenética
• Como essas interações regulam e impactam processos críticos, como o desenvolvimento embrionário
• Como processos aberrantes podem levar a distúrbios neurológicos, câncer e outras doenças.